De nombreuses maladies infectieuses, dont le COVID-19, sont transmises par des agents pathogènes aéroportés. Il est nécessaire de disposer de mesures efficaces de contrôle de l'environnement qui, idéalement, ne dépendent pas du comportement humain. Une solution potentielle est les lampes à excimères au chlorure de krypton (KrCl) (souvent appelées Far-UVC), qui peuvent inactiver efficacement les agents pathogènes, tels que les coronavirus et la grippe, dans l'air. La recherche démontre que lorsque les lampes KrCl sont filtrées pour éliminer les émissions ultraviolettes de plus grande longueur d'onde, elles n'induisent pas de réactions aiguës au niveau de la peau ou des yeux, ni d'effets retardés tels que le cancer de la peau. Bien qu'il existe des preuves en laboratoire de l'efficacité des UVC lointains, il existe des preuves limitées dans les pièces de grande taille. Pour la première fois, nous montrons que Far-UVC déployé dans une chambre de la taille d'une pièce inactive efficacement Staphylococcus aureus en aérosol. À un taux de ventilation de la pièce de 3 renouvellements d'air par heure (ACH), avec 5 sources filtrées, la charge pathogène à l'état d'équilibre a été réduite de 98,4%, fournissant 184 renouvellements d'air équivalents supplémentaires (eACH). Cette réduction a été obtenue en utilisant des irradiances UVC lointaines conformes aux valeurs limites actuelles de l'American Conference of Governmental Industrial Hygienists pour la peau pour une exposition continue de 8h. Nos données indiquent que Far-UVC est susceptible d'être plus efficace contre les virus aéroportés courants, y compris le SRAS-CoV-2, que les bactéries et devrait donc être une technologie efficace et «sans intervention» pour réduire la transmission des maladies aéroportées. Les résultats fournissent des données à l'échelle de la pièce pour soutenir la conception et le développement de systèmes Far-UVC efficaces.
Le coronavirus respiratoire aigu sévère 2 (SRAS-CoV-2), virus responsable de la pandémie de COVID-19, peut être transmis par un seul individu à une ou plusieurs personnes par transport viral dans des particules en suspension dans l'air (1, 2, 3, 4). Le risque de transmission aérienne du SRAS-CoV-2, à partir de tels événements, augmente dans les environnements intérieurs où de grands groupes de personnes se rassemblent, en particulier lorsque l'environnement est mal ventilé(5, 6).
Comme cela a été bien documenté, les niveaux élevés de transmission du SRAS-CoV-2 ont submergé les systèmes de santé nationaux, entraîné des millions de décès et causé des problèmes de santé à long terme. L'impact sur l'économie mondiale a été et continuera d'être dévastateur, ce qui a entraîné de nouveaux problèmes de bien-être et de santé publique.
Il est donc clair que la réduction ou la prévention de la transmission du SRAS-CoV-2 est un défi mondial critique et sans précédent. Les mesures de contrôle de la transmission ont inclus des fermetures nationales, des restrictions sur les rassemblements sociaux et professionnels, une meilleure ventilation intérieure, des campagnes de santé publique, des masques protecteurs et la vaccination. Ces mesures de contrôle ont des taux de réussite différents et chacune comporte ses propres défis. La vaccination a été l'une des mesures les plus efficaces pour réduire les décès et les maladies graves, bien que les preuves ne soient pas claires sur l'efficacité de la vaccination pour réduire la transmission des maladies (7, 8).
Les masques faciaux peuvent être une mesure de contrôle efficace pour réduire le risque de transmission par voie aérienne, mais reposent sur des choix comportementaux individuels, avec des niveaux élevés de conformité requis pour obtenir des impacts au niveau de la population sur la transmission (9, 10). À mesure que la pandémie de COVID-19 progresse dans le temps, il y a une acceptation et une adoption moindres des mesures de contrôle qui ont un impact sur la vie quotidienne, et donc un besoin accru de mesures efficaces qui ne reposent pas sur des choix comportementaux humains (11, 12).
Ceci est également important au-delà de COVID-19; la transmission par voie aérienne a été reconnue comme un mécanisme important pour un large éventail d'autres infections virales, notamment la grippe, la rougeole, d'autres coronavirus humains (SRAS-CoV, syndrome respiratoire du Moyen-Orient MERS-CoV) et le virus respiratoire syncytial (VRS) ainsi que pour les infections bactériennes. y compris la tuberculose et certains agents pathogènes responsables d'infections nosocomiales (13, 14, 15).
L'ultraviolet germicide (GUV) est une mesure de contrôle qui répond aux exigences ci-dessus, avec un bilan scientifique de succès. En 1942, Wells et al. (16) ont démontré une moindre transmission de la rougeole et des oreillons entre les enfants dans les salles de classe irradiées au GUV en haut de la chambre par rapport aux groupes témoins dans les chambres sans GUV. De même, Escombe et al. (16) ont démontré une réduction de plus de 70% de la transmission de la tuberculose des patients aux cobayes lorsque le GUV en haut de la chambre était utilisé, avec 35% d'infection tuberculeuse dans le groupe témoin et 9,5% d'infection dans le groupe avec GUV.
Cependant, un défi majeur pour les GUV 254nm conventionnels est l'exposition accidentelle des humains, qui peut entraîner des réactions potentiellement douloureuses de type coup de soleil au niveau de la peau et de la cornée (17). Cela limite la GUV traditionnelle à des systèmes de chambre haute soigneusement conçus, à des unités fermées ou à l'irradiation de pièces inoccupées (18). Même lorsqu'elles sont adoptées de cette manière, des expositions accidentelles peuvent toujours se produire et affecter l'adoption de la technologie (19, 20).
Une solution potentielle est « Far-UVC », un rayonnement ultraviolet-C germicide généralement dans la gamme de longueurs d'onde de 200 à 230nm. Les lampes excimères au chlorure de krypton (KrCl) avec une longueur d'onde d'émission primaire de 222nm et une faible émission résiduelle dans toute la région ultraviolette du spectre électromagnétique (21) sont une source courante d'UV-C lointains. Les propriétés germicides des lampes à excimère KrCl ont été démontrées dans des expériences de laboratoire pour inactiver les bactéries gram-positives et gram-négatives, les bactéries résistantes aux médicaments, les virus de la grippe et les coronavirus humains, y compris le virus SARS-CoV-2. (22, 23, 24, 25, 26, 27, 28).
Il est important de noter que lorsqu'elles sont filtrées pour minimiser les émissions ultraviolettes à des longueurs d'onde supérieures à 230nm, les lampes à excimère KrCl Far-UVC sont beaucoup moins susceptibles que les sources GUV conventionnelles (254nm) d'induire des effets indésirables aigus sur la peau et les yeux, et les études à ce jour chez l'animal et les modèles humains n'ont pas démontré d'effets néfastes à long terme sur la santé (21, 29, 30, 31, 32, 33, 34).
Bien que les résultats de laboratoire soient encourageants, l'inactivation d'un agent pathogène dans un environnement de laboratoire contrôlé à l'échelle du laboratoire ne se traduit pas nécessairement par une réduction de la transmission de la maladie lorsque la technologie est déployée avec des limitations « réelles » (35, 36). Le précédent historique avec les GUV en haut de la chambre donne une certaine confiance dans le potentiel des UVC lointains pour réduire la transmission de la maladie, mais il reste un besoin non satisfait d'évaluations dans le monde réel (16, 37). De telles études sont complexes et doivent être réalisées sur des périodes prolongées (généralement au moins 12 mois). Une étape translationnelle vers des études dans le monde réel consiste en des expériences dans de grandes chambres à aérosols de la taille d'une pièce. Ces chambres de la taille d'une pièce, avec débit d'air, température et humidité contrôlés, sont conçues pour reproduire un environnement réel. Ces espaces ont été utilisés pour démontrer l'efficacité des systèmes GUV en haut de la chambre et pour étudier la survie et la dispersion des micro-organismes (38, 39, 40, 41, 42, 43).
Ils peuvent également fournir des informations importantes sur l'application des technologies dans les pièces où une personne infectieuse peut être présente pendant une période prolongée, une situation courante dans les écoles, les lieux de travail, les hôpitaux et les lieux d'accueil. Avec la libération continue et contrôlée d'agents pathogènes en suspension dans l'air, permettant d'obtenir un environnement stable, l'air à l'intérieur de la chambre peut être régulièrement échantillonné avec et sans les technologies de désinfection de l'air environnemental, fournissant une indication plus proche des performances réelles. Ici, nous étudions pour la première fois l'efficacité des Far-UVC pour inactiver un agent pathogène en suspension dans l'air dans des conditions d'équilibre dans une chambre à bioaérosols à grande échelle.
Résultats :
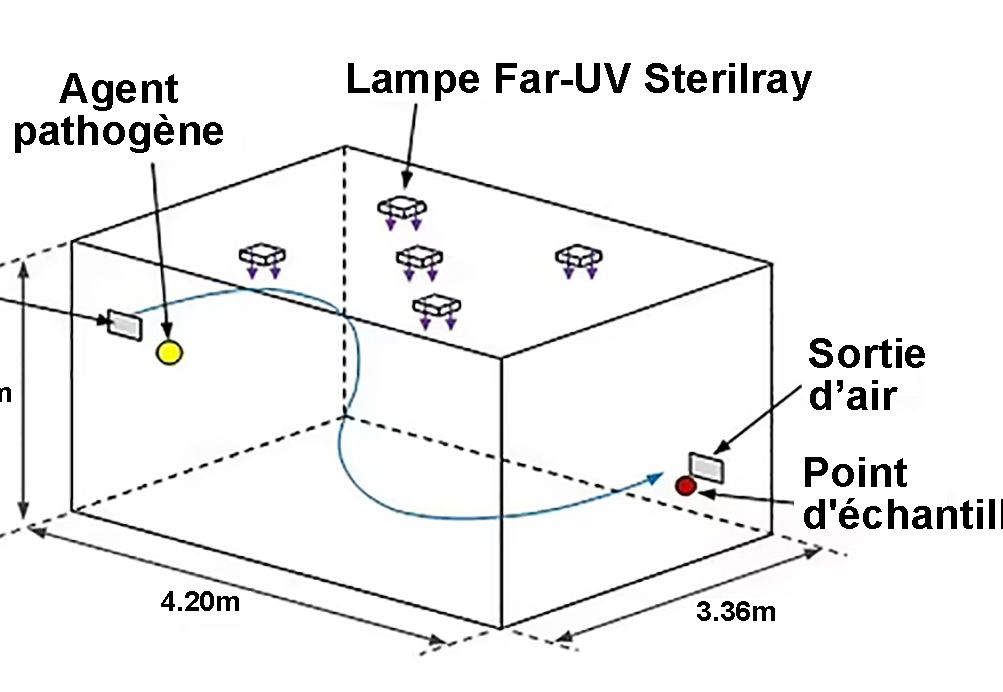
Cinq lampes à excimères de chlorure de krypton, filtrées pour réduire les émissions ultraviolettes à des longueurs d'onde supérieures à 230nm et avec des diffuseurs fixés à leur fenêtre d'émission pour élargir leur schéma d'irradiation, ont été fixées au plafond d'une chambre à bioaérosols de la taille d'une pièce à l'Université de Leeds. les lampes étaient disposées en quinconce (Fig. 1) avec leur émission dirigée vers le sol. Les études ont été entreprises soit avec les cinq lampes allumées, soit avec la seule lampe centrale allumée. Cela a été fait pour étudier l'effet d'une irradiation partielle (une lampe) et complète (cinq lampes) du volume de la pièce. La chambre de 32m³ ventilée mécaniquement a fonctionné à un taux de ventilation de trois renouvellements d'air par heure (ACH) et une libération continue de Staphylococcus aureus en aérosol a été introduite dans la chambre à une hauteur de 168cm. Après une période de stabilisation de 60min, 10 échantillons d'air ont été prélevés sur une période de 50min. Ensuite, une (la lampe centrale Far-UVC) ou cinq sources Far-UVC ont été allumées et l'échantillonnage s'est poursuivi pendant 50 minutes supplémentaires.
Schémas 3D de la configuration de la chambre bioaérosol montrant les dimensions de la pièce, la position des lampes, la source d'agents pathogènes et le point de collecte (en haut) avec un exemple illustratif des émissions de la lampe Far-UVC (en bas).
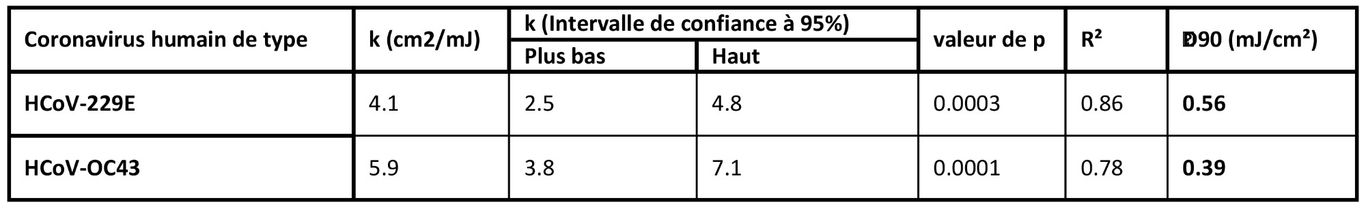
La survie des coronavirus en fonction de la dose de lumière UV-C lointaine. La survie fractionnelle, PFUUV / PFUcontrols, est tracée en fonction de la dose de lumière UV-C lointaine de 222nm. Les résultats sont rapportés sous forme d'estimation des unités formatrices de plaques (PFU)/ml en utilisant la conversion PFU/ml = 0.7 TCID50 (29) en appliquant la distribution de Poisson. Les valeurs sont rapportées en tant que moyenne ± SEM de plusieurs expériences (n = 3 pour l'alpha HCoV-229E et n = 4 pour le beta HCoV-OC43) ; les lignes représentent les régressions les mieux ajustées à l'équation (1) (voir texte et tableau ci-dessous).
Tableau : Paramètres de régression linéaire pour les valeurs ln[S] [survie] normalisées (équation 1) en tant que variable dépendante et la dose UV (D, mJ/cm2) en tant que variable indépendante. k est la constante de vitesse d'inactivation UV ou le facteur de susceptibilité (cm²/mJ). La régression linéaire a été effectuée avec le terme d'interception fixé à zéro, ce qui représente la définition d'une survie relative de 100% à une dose UV nulle. La section transversale d'inactivation du coronavirus, D90 (la dose UV qui inactive 90% du virus exposé) a été calculée en utilisant D90 = - ln[1 - 0,90]/k.
Test d'intégration virale
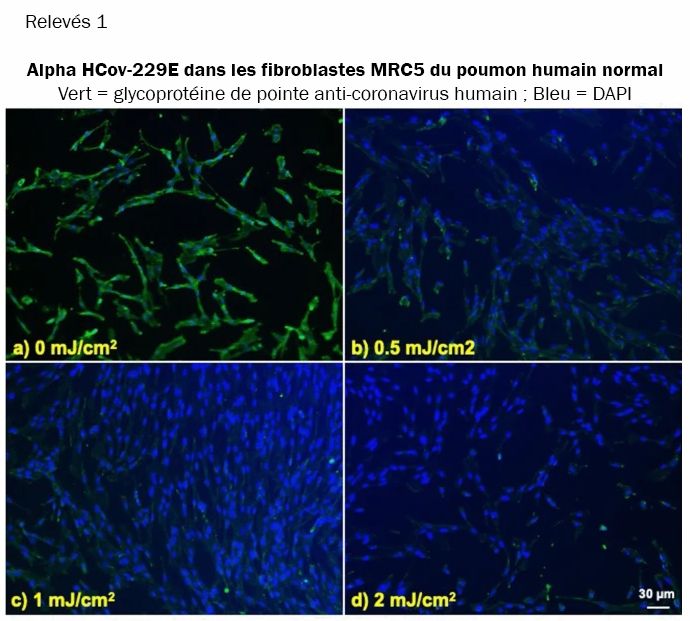
Nous avons étudié l'intégration du coronavirus dans les cellules hôtes pulmonaires humaines, toujours après exposition des aérosols à différentes doses de lumière UV-C lointaine. Les relevés 1 et 2 montrent des images fluorescentes 10x représentatives de cellules pulmonaires humaines MRC-5 et WI-38 incubées, respectivement, avec HCoV-229E (relevés 1) et HCoV-OC43 (relevés 2), qui ont été exposés sous forme d'aérosols à différentes doses d'UVC lointain. La solution virale a été recueillie dans le BioSampler après avoir traversé la chambre aérosol tout en étant exposée à 0, 0.5, 1 ou 2mJ/cm² de lumière 222nm. Les cellules ont été incubées avec le virus exposé pendant une heure, le milieu a été remplacé par un milieu d'infection frais et l'immunofluorescence a été réalisée 24 heures plus tard. Nous avons évalué l'expression de la glycoprotéine de l'épi viral dans les lignées cellulaires humaines, dont la sous-unité fonctionnelle S2 est hautement conservée parmi les coronavirus (31, 32). Dans les relevés 1 et 2, la fluorescence verte (Alexa Fluor-488 utilisé comme anticorps secondaire contre l'anticorps anti-glycoprotéine de pointe du coronavirus humain) indique qualitativement l'infection des cellules par le virus vivant, tandis que les noyaux ont été contre-colorés avec du DAPI apparaissant comme une fluorescence bleue. Pour l'alpha HCoV-229E et le beta HCoV-OC43, l'exposition à la lumière de 222nm a réduit l'expression de la glycoprotéine virale de pointe comme indiqué par une réduction de la fluorescence verte.
Infection de cellules pulmonaires humaines par l'alpha HCoV-229E irradié en aérosol en fonction de la dose de lumière UV-C lointaine. Images fluorescentes représentatives de fibroblastes de poumon humain normal MRC-5 infectés par l'alpha coronavirus humain 229E exposé sous forme d'aérosol. La solution virale a été recueillie dans le BioSampler après avoir traversé la chambre d'aérosol tout en étant exposée à (a) 0, (b) 0.5, (c) 1 ou (d) 2mJ/cm² de lumière 222nm. La fluorescence verte indique qualitativement les cellules infectées (vert = Alexa Fluor-488 utilisé comme anticorps secondaire contre l'anticorps anti-glycoprotéine de pointe du coronavirus humain ; bleu = colorant nucléaire DAPI). Les images ont été acquises avec un objectif 10× ; la barre d'échelle s'applique à tous les panneaux des relevés 1.
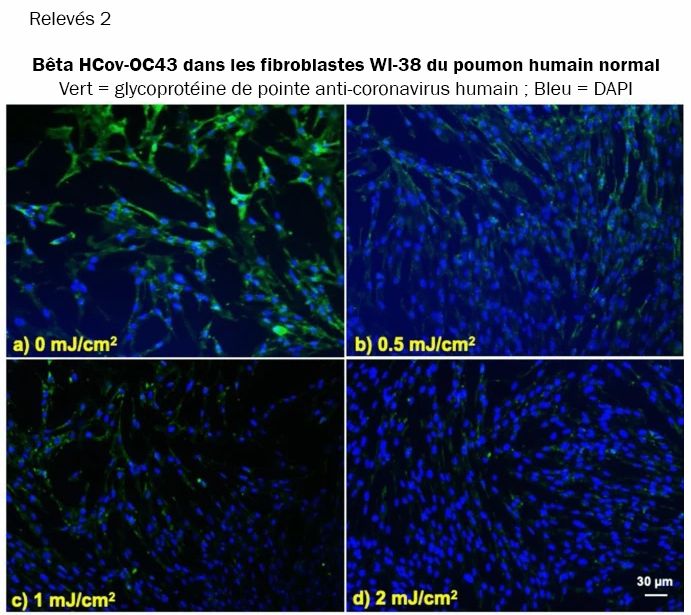
Infection de cellules pulmonaires humaines à partir d'aérosols irradiés de beta HCoV-OC43 en fonction de la dose de lumière UV-C lointaine. Images fluorescentes représentatives de fibroblastes de poumon humain normal WI-38 infectés par le beta coronavirus humain OC43 exposé sous forme d'aérosol. La solution virale a été recueillie dans le BioSampler après avoir traversé la chambre d'aérosol tout en étant exposée à (a) 0, (b) 0.5, (c) 1 ou (d) 2mJ/cm² de lumière 222nm. La fluorescence verte indique qualitativement les cellules infectées (vert = Alexa Fluor-488 utilisé comme anticorps secondaire contre l'anticorps anti-glycoprotéine de pointe du coronavirus humain ; bleu = colorant nucléaire DAPI). Les images ont été acquises avec un objectif 10× ; la barre d'échelle s'applique à tous les panneaux de la figure.
Discussion
La gravité de la pandémie de COVID-19 en 2020 justifie le développement et le déploiement rapides de contre-mesures efficaces pour réduire la transmission de personne à personne à l'intérieur des bâtiments. Nous avons mis au point une approche prometteuse utilisant une lumière UV-C lointaine de 222nm générée par des lampes excimères filtrées, qui inactive les virus aéroportés sans induire de dommages biologiques dans les cellules et les tissus humains exposés (11, 12, 13, 14, 15, 16, 17, 18). Cette approche repose sur le principe biophysique selon lequel la lumière UV-C lointaine, en raison de sa pénétration très limitée dans les matériaux biologiques, peut traverser et tuer des virus et des bactéries dont les dimensions sont généralement de l'ordre du micromètre ou plus petites, mais ne peut pas pénétrer même les couches externes de cellules mortes de la peau humaine, ni la couche lacrymale externe à la surface de l'œil humain (12).
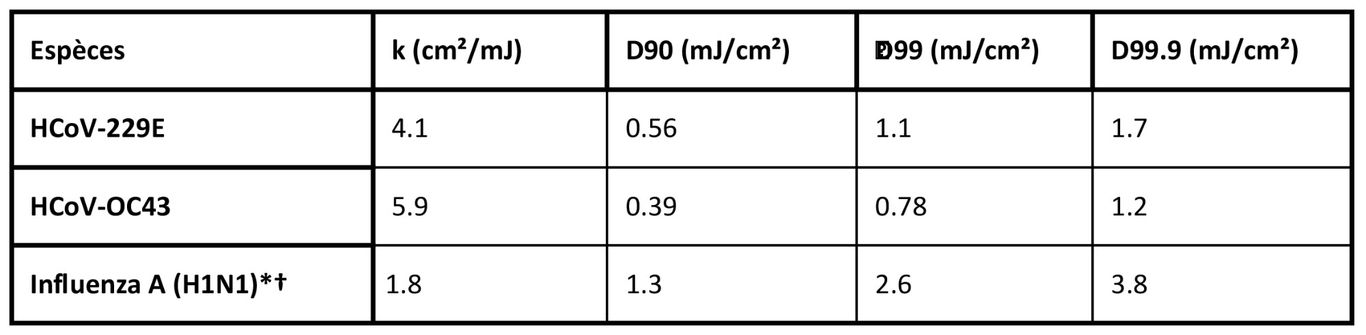
Dans ce travail, nous avons utilisé une chambre d'irradiation d'aérosol pour tester l'efficacité de la lumière UV-C lointaine de 222nm pour inactiver deux coronavirus humains en aérosol, le beta HCoV-OC43 et l'alpha HCoV-229E. Comme le montre les relevés 1, l'inactivation des deux coronavirus humains par la lumière de 222nm suit un modèle de désinfection exponentiel typique, avec une constante d'inactivation pour HCoV-229E de k = 4.1cm²/mJ (95% C.I. 2.5-4.8), et k = 5.9cm²/mJ (95% C.I. 3.8-7.1) pour HCoV-OC43. Ces valeurs impliquent que des doses de lumière UV de 222nm de seulement 1.7mJ/cm² ou 1.2mJ/cm² respectivement produisent une inactivation de 99.9% (réduction de 3 log) de l'alpha HCoV-229E ou du beta HCoV-OC43 aérosolisés. Le tableau ci-dessous présente un résumé des valeurs de k et des valeurs correspondantes de D90, D99 et D99.9 que nous avons obtenues pour les coronavirus, ainsi que nos résultats antérieurs pour le virus de la grippe H1N1 en aérosol (23). La différence relativement faible de sensibilité des coronavirus de la grippe A (H1N1) et des coronavirus humains à la lumière de 222nm est probablement attribuable aux différences de structure, de taille du génome et de configuration des acides nucléiques (33). Il est également important de noter que les résultats précédents avec le virus H1N1 utilisaient un test de concentration fluorescente pour évaluer la survie du virus (23), contrairement au présent travail qui a utilisé le test TCID50. Si les deux tests sont largement utilisés pour déterminer avec précision l'infectivité virale (34), le premier utilise l'immunofluorescence pour détecter un antigène viral spécifique, au lieu de dépendre des effets cytopathiques comme dans le test TCID50. Les méthodes et les principes de ces tests étant différents, on peut s'attendre à une certaine variance entre ces deux techniques.
* Les valeurs D99 et D99.9 pour la grippe A (H1N1) sont des valeurs extrapolées, car ces doses n'ont pas été utilisées pendant les tests (23).
† Nos travaux antérieurs sur le H1N1 utilisaient le test du foyer fluorescent (23), tandis que les travaux actuels sur les coronavirus utilisent le test TCID50.
Les résultats suggèrent que les deux souches de coronavirus étudiées présentent une sensibilité élevée similaire à l'inactivation par UV-C lointain. La régression linéaire robuste a produit des intervalles de confiance à 95% qui se chevauchent pour la constante de vitesse d'inactivation, k, de 2.5 à 4.8cm²/mJ et de 3.8 à 7.1cm²/mJ respectivement pour les souches 229E et OC43. Comme tous les coronavirus humains ont des tailles génomiques similaires, ce qui est un déterminant primaire de la sensibilité aux UV (27), il est raisonnable de s'attendre à ce que la lumière UV-C lointaine présente une efficacité d'inactivation similaire contre tous les coronavirus humains, y compris le SARS-CoV-2. Les données obtenues ici sont conformes à cette hypothèse.
Il est utile de comparer les performances de la lumière UVC lointaine avec l'exposition UV-C germicide classique (pic à 254nm). Nous ne connaissons qu'une seule étude de ce type (35), qui a utilisé un bêta-coronavirus murin en aérosol. L'étude a rapporté un D88 de 0.599mJ/cm², que d'autres (4) ont utilisé pour estimer le D90 du virus avec une lumière de 254nm à 0.6mJ/cm². Cette valeur est similaire à celles estimées dans les travaux actuels (voir tableau ci-dessus), ce qui suggère une efficacité d'inactivation similaire des UV-C lointains de 222nm et des UV-C germicides conventionnels de 254nm pour les coronavirus en aérosol, et apporte un soutien supplémentaire à la suggestion selon laquelle tous les coronavirus ont des sensibilités similaires à la lumière UV.
La sensibilité des coronavirus à la lumière UV-C lointaine, ainsi que les nombreuses données de sécurité, même pour des expositions aux UV-C lointains beaucoup plus élevées (12, 13, 14, 15, 16, 17, 18), suggèrent qu'il pourrait être faisable et sûr d'avoir des lampes fournissant une exposition continue à de faibles doses d'UV-C lointains dans les lieux publics - réduisant potentiellement la probabilité de transmission de personne à personne du coronavirus ainsi que d'autres virus saisonniers tels que la grippe. En fait, il existe une limite réglementaire quant à la quantité de lumière de 222nm à laquelle le public peut être exposé, qui est de 23mJ/cm² par exposition de 8 heures (36, 37). D'après les résultats obtenus ici pour le coronavirus bêta HCoV-OC43, une exposition continue aux UV-C lointains à cette limite réglementaire entraînerait une inactivation virale de 90% en 8 minutes environ, de 95% en 11 minutes environ, de 99% en 16 minutes environ et de 99.9% en 25 minutes environ. Ainsi, la désinfection continue de l'air avec la lumière UV-C lointaine à la limite réglementaire actuelle permettrait une réduction importante du niveau ambiant de virus en suspension dans l'air dans les environnements intérieurs occupés.
En conclusion, nous avons montré que de très faibles doses de lumière UV-C lointaine tuent efficacement les coronavirus humains aéroportés transportés par les aérosols. Une dose aussi faible que 1.2 à 1.7mJ/cm² de lumière 222nm inactive 99.9% des coronavirus humains aéroportés testés des deux genres beta et alpha, respectivement. Comme tous les coronavirus humains ont une taille génomique similaire, un déterminant clé de la sensibilité aux rayonnements (27), il est probable que la lumière UV-C lointaine montrera une efficacité d'inactivation comparable contre d'autres coronavirus humains, y compris le SARS-CoV-2.
Avec les études de sécurité précédentes (12, 13, 14, 15, 16, 17, 18) et nos études antérieures avec la grippe A (H1N1) (23), ces résultats suggèrent l'utilité de la lumière UV-C lointaine continue à faible débit de dose dans les lieux publics intérieurs occupés tels que les hôpitaux, les véhicules de transport, les restaurants, les aéroports et les écoles, représentant potentiellement un outil sûr et peu coûteux pour réduire la propagation des virus transmis par voie aérienne. Tout en restant dans les limites de dose réglementaires actuelles, l'exposition aux UV-C lointains à faible débit de dose peut potentiellement permettre de réduire considérablement et en toute sécurité le niveau ambiant de coronavirus transmis par voie aérienne, notamment le SRAS-CoV-2.
Méthodes
Les souches virales
Le HCoV-229E (VR-740) et le HCoV-OC43 (VR-1558) ont été propagés dans des fibroblastes pulmonaires diploïdes humains MRC-5 (CCL-171) et WI-38 (CCL-75), respectivement (tous provenant de ATCC, Manassas, VA). Les deux lignées cellulaires humaines ont été cultivées dans du MEM complété par 10% de sérum fœtal de bovin (FBS), 2mM de L-alanyl-L-glutamine, 100U/ml de pénicilline et 100μg/ml de streptomycine (Sigma-Aldrich Corp. St. Louis, MO, USA). Le milieu d'infection virale était constitué de MEM ou de RPMI-1640 plus 2% de FBS inactivé par la chaleur pour HCoV-229E et HCoV-OC43, respectivement. Les souches virales ont été propagées par inoculation de flacons contenant des cellules hôtes vieilles de 24 heures, qui étaient confluentes à 80-90%. Après une heure d'incubation, la monocouche cellulaire a été lavée et incubée dans un milieu d'infection frais pendant trois ou quatre jours à 35°C pour HCoV-229E et à 33°C pour HCoV-OC43. Le surnageant contenant le stock viral actif a ensuite été recueilli par centrifugation (300 g pendant 15 minutes). Le titre viral a été déterminé par la dose infectieuse de 50% de la culture tissulaire TCID50 en évaluant les effets cytopathiques (ECP), qui ont été notés au microscope à fond clair (10×) comme la vacuolisation du cytoplasme, l'arrondissement des cellules et la desquamation.
Chambre d'irradiation d'aérosols de paillasse
Une chambre d'irradiation aérosol/virus dynamique à passage unique a été utilisée pour générer, exposer et collecter des échantillons d'aérosols comme décrit précédemment (23). Les aérosols viraux ont été générés en ajoutant une solution virale dans un nébuliseur de thérapie respiratoire à aérosol étendu à haut débit (Westmed, Tucson, AZ) et en utilisant une pompe à air avec un débit d'entrée de 11L/min. Le virus s'est écoulé dans la chambre et a été mélangé à de l'air sec et humidifié pour maintenir l'humidité entre environ 50 et 70%. L'humidité relative, la température et la distribution granulométrique de l'aérosol ont été contrôlées tout au long du fonctionnement. L'aérosol a été exposé à la lumière UV-C lointaine et finalement collecté à l'aide d'un BioSampler (SKC Inc., Eighty Four, PA).
La lampe UV lointaine était placée à environ 22cm de la chambre d'exposition aux UV et dirigée vers la fenêtre en plastique transmettant les UV de 26cm × 25.6cm × 254μm (TOPAS 8007 × 10, TOPAS Advanced Polymers Inc., Florence, KY). Conformément à nos expériences précédentes utilisant cette chambre (23), le débit à travers le système était de 12.5L/min. Le volume de la zone d'exposition aux UV était de 4.2L, de sorte que chaque aérosol était exposé pendant environ 20 secondes lorsqu'il traversait la fenêtre. L'ensemble de la chambre d'irradiation était contenu dans une armoire de biosécurité de niveau 2 et toutes les entrées et sorties d'air étaient équipées de filtres HEPA (GE Healthcare Bio-Sciences, Pittsburgh, PA) pour empêcher toute contamination indésirable d'entrer ou de sortir du système.
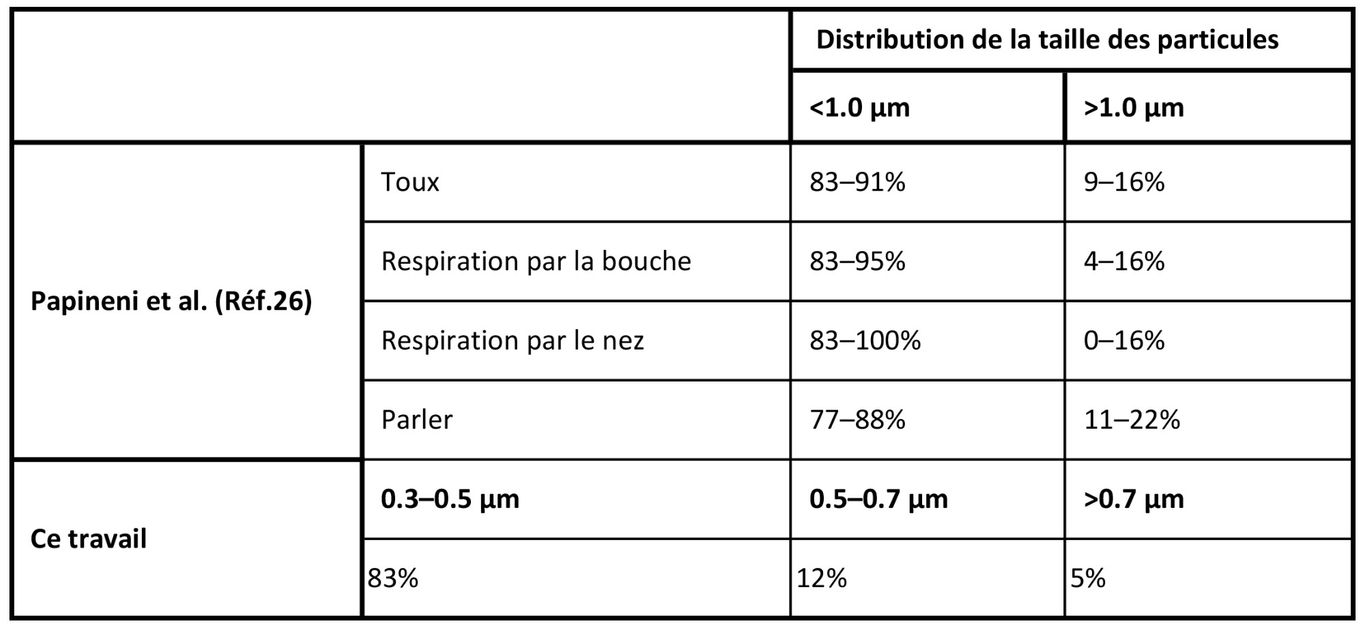
Performances de la chambre d'irradiation
La chambre d'irradiation personnalisée a simulé la transmission de virus en aérosol produits par la toux et la respiration humaines. La chambre a fonctionné à une humidité relative moyenne de 66% et à une température moyenne de 24°C pour toutes les séries. La distribution moyenne de la taille des particules était de 83% entre 0.3μm et 0.5μm, 12% entre 0.5μm et 0.7μm, et 5% > 0.7μm (voir tableau ci-dessous). Les virus aérosolisés ont été efficacement transmis par le système, comme en témoigne le témoin (exposition nulle) présentant une intégration virale claire (relevés 1 et 2, panneaux supérieurs gauches).
Tableau : des exemples de distributions de la taille des particules provenant d'humains au cours de diverses activités sont donnés (26) ainsi que les valeurs moyennes mesurées pour ce travail.
Lampe UV-C lointaine et dosimétrie
La source d'UV-C lointains utilisée dans cette étude était un module de lampe excimère KrCl de 12W 222nm fabriqué par USHIO America (article #9101711, Cypress, CA). La lampe est équipée d'une fenêtre de filtrage optique exclusive pour réduire les émissions de la lampe en dehors du pic d'émission de 222nm du KrCl. La lampe a été positionnée à 22cm de la fenêtre de la chambre d'exposition et dirigée vers le centre de la fenêtre. Les mesures de la puissance optique ont été effectuées à l'aide d'un photodétecteur en silicium amélioré par l'UV à faible puissance 818-UV/DB avec un wattmètre optique 843-R (Newport, Irvine, CA). La dosimétrie a été effectuée avant le début de l'expérience afin de mesurer la fluence à l'intérieur de la chambre à l'emplacement de l'aérosol.
La distance entre la lampe et la chambre d'irradiation a permis à une seule lampe d'irradier uniformément toute la zone de la fenêtre d'exposition. Les mesures effectuées à l'aide du photodétecteur en silicium ont indiqué une intensité d'exposition d'environ 90μW/cm² sur toute la zone d'exposition. La chambre est équipée d'une surface en aluminium réfléchissante opposée à la fenêtre d'exposition. Comme dans nos précédents travaux avec cette chambre (23), la réflectivité de cette surface était d'environ 15%. Nous avons donc estimé de manière conservatrice que l'intensité sur l'ensemble de la zone d'exposition était de 100μW/cm². La lampe étant positionnée à 22cm de la fenêtre et compte tenu des 20 secondes nécessaires à une particule aérosol pour traverser la fenêtre d'exposition, nous avons calculé que la dose d'exposition totale à une particule était de 2 mJ/cm². Nous avons utilisé des feuilles supplémentaires de fenêtres en plastique transmettant les UV pour réduire uniformément l'intensité à travers la région d'exposition afin de créer différentes conditions d'exposition. Alors que dans nos travaux précédents avec ces feuilles, nous avons mesuré une transmission plus proche de 65% (23), pour ces tests, nous avons mesuré la transmission 222nm de chaque feuille à environ 50%. Cette diminution de la transmission est probablement due à la photodégradation du plastique au fil du temps (4). L'ajout d'une ou deux feuilles de plastique couvrant la fenêtre d'exposition diminue la dose d'exposition à 1 et 0.5mJ/cm², respectivement.
Protocole expérimental
Comme décrit précédemment (23), la solution virale dans le nébuliseur consistait en 1ml de milieu d'Eagle modifié (MEM, Life Technologies, Grand Island, NY) contenant 107-108 TCID50 de coronavirus, 20ml d'eau désionisée et 0.05ml de solution saline équilibrée de Hank avec calcium et magnésium (HBSS++). La chambre d'irradiation a fonctionné avec des particules virales en aérosol circulant dans la chambre et le canal de dérivation pendant 5 minutes avant chaque prélèvement, afin d'établir la valeur d'humidité relative souhaitée. Le prélèvement des échantillons a été initié en modifiant le flux d'air du canal de dérivation vers le BioSampler à l'aide d'un ensemble de vannes à trois voies. Le BioSampler a été initialement rempli de 20ml de HBSS++ pour capturer l'aérosol. Pendant chaque période d'échantillonnage, qui a duré 30 minutes, l'intérieur de la chambre d'irradiation a été exposé à une lumière UV-C lointaine de 222nm entrant par la fenêtre en plastique. La variation de la dose d'UV-C lointains délivrée aux particules d'aérosol a été obtenue en insérant des films plastiques transparents aux UV supplémentaires comme décrit ci-dessus, délivrant ainsi les trois doses d'essai de 0.5, 1.0 et 2.0 mJ/cm². Les études de contrôle à dose nulle ont été réalisées avec la lampe excimère éteinte. Une fois la période d'échantillonnage terminée, la solution du BioSampler a été utilisée pour les essais d'infectivité virale.
Tests d'infectivité virale
TCID50
Nous avons utilisé le test de la dose infectieuse à 50% sur culture tissulaire pour déterminer l'infectivité du virus (28). En bref, 105 cellules hôtes ont été placées dans chaque puits de plaques à 96 puits le jour précédant l'expérience. Les cellules ont été lavées deux fois dans du HBSS++ et des dilutions sérielles 1:10 dans le milieu d'infection du virus exposé provenant du BioSampler ont été superposées aux cellules pendant deux heures. Les cellules ont ensuite été lavées deux fois dans du HBSS++, recouvertes de milieu d'infection frais et incubées pendant trois ou quatre jours à 34°C. Les effets cytopathiques (ECP) ont été notés au microscope à fond clair (10×) comme la vacuolisation du cytoplasme, l'arrondissement des cellules et la desquamation. La DICT50 a été calculée selon la méthode de Reed et Muench (28, 38). Pour confirmer les scores de l'ECP, les échantillons ont été fixés dans du méthanol à 100% pendant cinq minutes et colorés avec du cristal violet à 0.1%. Les résultats sont rapportés en tant qu'estimation des unités formatrices de plaques (UFP)/ml en utilisant la conversion UFP/ml = 0.7 DICT50 en appliquant la distribution de Poisson (29).
Immunofluorescence
Pour évaluer si des doses croissantes de lumière de 222nm réduisaient le nombre de cellules infectées, nous avons effectué un protocole standard d'immunocoloration fluorescente pour détecter un antigène viral dans les cellules humaines hôtes (23). En bref, 2 × 105 cellules hôtes (cellules MRC-5 pour HCoV-229E et WI-38 pour HCoV-OC43) ont été placées dans chaque puits de plaques à 48 puits le jour précédant l'expérience. Après un passage dans la chambre d'irradiation pendant 30 minutes, 150μl de suspension virale recueillie dans le BioSampler ont été superposés sur la monocouche de cellules hôtes. Les cellules ont été incubées avec le virus pendant une heure, puis lavées trois fois avec du HBSS++, et enfin incubées pendant la nuit dans un milieu d'infection frais. Les cellules infectées ont ensuite été fixées dans du méthanol glacé à 100% à 4°C pendant 5 minutes et marquées avec une glycoprotéine de pointe anti-coronavirus humain (40021-MM07, Sino Biologicals US Inc., Chesterbrook, PA) au 1:200 dans du HBSS++ contenant 1% d'albumine de sérum bovin (BSA ; Sigma-Aldrich Corp. St. Louis, MO, USA) à température ambiante pendant une heure en agitant légèrement. Les cellules ont été lavées trois fois dans du HBSS++ et marquées avec de l'anti-souris de chèvre Alexa Fluor-488 (Life Technologies, Grand Island, NY) 1:800 dans du HBSS++ contenant 1% de BSA, à température ambiante pendant 30 minutes dans l'obscurité avec une légère agitation. Après trois lavages dans HBSS++, les cellules ont été colorées avec du Vectashield contenant du DAPI (4′,6-diamidino-2-phénylindole) (Vector Laboratories, Burlingame, CA) et observées avec l'objectif 10× d'un microscope à fluorescence Olympus IX70 équipé d'un appareil photo numérique à haute résolution et à haut rendement Photometrics PVCAM et du logiciel Image-Pro Plus 6.0 (Media Cybernetics, Bethesda, MD). Pour chaque dose de 222nm et chaque genre de virus, les résultats représentatifs ont été répétés deux fois. Pour chaque échantillon, jusqu'à dix champs de vue d'images fusionnées de DAPI et d'Alexa Fluor-488 ont été acquis.
Analyse des données
La fraction survivante (S) du virus a été calculée en divisant la fraction PFU/ml à chaque dose d'UV (PFUUV) par la fraction à dose nulle (PFUcontrols) : S = PFUUV/PFUcontrols. Les valeurs de survie ont été calculées pour chaque expérience répétée et transformées en logarithme naturel (ln) pour rapprocher la distribution des erreurs de la normale (39). Une régression linéaire robuste utilisant les moindres carrés itérés repondérés (IWLS) (40, 41) a été effectuée dans le logiciel R 3.6.2 en utilisant ces valeurs ln[S] normalisées comme variable dépendante et la dose d'UV (D, mJ/cm²) comme variable indépendante. Grâce à cette approche, la survie du virus [S] a été décrite par une cinétique de premier ordre selon l'équation (4) :
ln(S) = -k x D
où k est la constante de vitesse d'inactivation UV ou le facteur de susceptibilité (cm²/mJ). La régression a été effectuée avec le terme d'interception fixé à zéro, ce qui représente la définition d'une survie relative de 100% à une dose UV nulle, séparément pour chaque souche virale étudiée. Les données à la dose zéro, qui par définition représentent ln[S] = 0, n'ont pas été incluses dans la régression. Les incertitudes (intervalles de confiance à 95%, IC) pour le paramètre k de chaque souche virale ont été estimées par bootstrapping pour chaque méthode de régression, car le bootstrapping peut donner lieu à des estimations d'incertitude plus réalistes, par rapport à l'approximation analytique standard basée sur la normalité asymptotique, dans de petits ensembles de données comme ceux utilisés ici (n = 3 pour HCoV-229E et n = 4 pour HCoV-OC43). La qualité de l'ajustement a été évaluée par le coefficient de détermination (R2). L'analyse des résidus pour l'autocorrélation et l'hétéroscédasticité a été effectuée à l'aide du test de Durbin-Watson (42) et du test de Breusch-Pagan (mis en œuvre par le paquet R lmtest) (43), respectivement. Les estimations des paramètres (k) pour chaque souche virale ont été comparées entre elles sur la base des IC à 95% et directement par un test t, en utilisant les tailles d'échantillon, les valeurs de k et leurs erreurs standard. La section transversale d'inactivation du virus, D90, qui est la dose d'UV qui inactive 90% du virus exposé, a été calculée comme suit : D90 = - ln[1 - 0,90]/k. Les autres valeurs de D ont été calculées de manière similaire.
Disponibilité des données
Le fichier de jeu de données généré et/ou analysé au cours de la présente étude est disponible dans le dépôt Open Science Framework (OSF), identifiant : DOI 10.17605/OSF.IO/KGZAF.
Références
- Organisation mondiale de la santé. Rapports de situation sur les maladies à coronavirus (COVID-2019). Disponible sur : https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports (2020).
- van Doremalen, N. et al. Aerosol and surface stability of sars-cov-2 as compared with sars-cov-1. N. Engl. J. Med, (2020).
- Bai, Y. et al. Presumed asymptomatic carrier transmission of covid-19. JAMA, (2020).
- Kowalski, W. J. Ultraviolet Germicidal Irradiation Handbook: UVGI for Air and Surface Disinfection. New York: Springer, (2009).
- Budowsky, E. I. et al. Principles of selective inactivation of viral genome. I. UV-induced inactivation of influenza virus. Arch. Virol. 68(3-4), 239–47 (1981).
- Naunovic, Z., Lim, S. & Blatchley, E. R. III. Investigation of microbial inactivation efficiency of a UV disinfection system employing an excimer lamp. Water Res. 42(19), 4838–46 (2008).
- Trevisan, A. et al. Unusual high exposure to ultraviolet-C radiation. Photochem. Photobiol. 82(4), 1077–9 (2006).
- Zaffina, S. et al. Accidental exposure to UV radiation produced by germicidal lamp: case report and risk assessment. Photochem. Photobiol. 88(4), 1001–4 (2012).
- Setlow, R. B. et al. Wavelengths effective in induction of malignant melanoma. Proc. Natl Acad. Sci. USA 90(14), 6666–70 (1993).
- Balasubramanian, D. Ultraviolet radiation and cataract. J. Ocul. Pharmacol. Ther. 16(3), 285–97 (2000).
- Narita, K. et al. 222-nm UVC inactivates a wide spectrum of microbial pathogens. J Hosp Infect (2020).
- Buonanno, M. et al. 207-nm UV light - a promising tool for safe low-cost reduction of surgical site infections. I: in vitro studies. Plos One 8(10), e76968 (2013).
- Buonanno, M. et al. 207-nm UV light-a promising tool for safe low-cost reduction of surgical site infections. II: In-Vivo Safety Studies. PLoS One 11(6), e0138418 (2016).
- Buonanno, M. et al. Germicidal efficacy and mammalian skin safety of 222-nm uv light. Radiat. Res. 187(4), 483–491 (2017).
- Ponnaiya, B. et al. Far-UVC light prevents MRSA infection of superficial wounds in vivo. Plos One 13(2), e0192053 (2018).
- Narita, K. et al. Disinfection and healing effects of 222-nm UVC light on methicillin-resistant Staphylococcus aureus infection in mouse wounds. J. Photochem. Photobiol. B 178(Supplement C), 10–18 (2018).
- Narita, K. et al. Chronic irradiation with 222-nm UVC light induces neither DNA damage nor epidermal lesions in mouse skin, even at high doses. PLoS One 13(7), e0201259 (2018).
- Yamano, N. et al. Long-term effects of 222 nm ultraviolet radiation C sterilizing lamps on mice susceptible to ultraviolet radiation. Photochem Photobiol, (2020).
- Goldfarb, A. R. & Saidel, L. J. Ultraviolet absorption spectra of proteins. Science 114(2954), 156–7 (1951).
- Setlow, J. The molecular basis of biological effects of ultraviolet radiation and photoreactivation, in Current topics in radiation research, M. Ebert & A. Howard, Editors., North Holland Publishing Company: Amsterdam. p. 195–248 (1966).
- Coohill, T. P. Virus-cell interactions as probes for vacuum-ultraviolet radiation damage and repair. Photochem. Photobiol. 44(3), 359–63 (1986).
- Green, H. et al. Cytotoxicity and mutagenicity of low intensity, 248 and 193 nm excimer laser radiation in mammalian cells. Cancer Res. 47(2), 410–3 (1987).
- Welch, D. et al. Far-UVC light: A new tool to control the spread of airborne-mediated microbial diseases. Sci. Rep. 8(1), 2752 (2018).
- Fehr, A. R. & Perlman, S. Coronaviruses: an overview of their replication and pathogenesis. Methods Mol. Biol. 1282, 1–23 (2015).
- Woo, P. C. et al. Coronavirus genomics and bioinformatics analysis. Viruses 2(8), 1804–20 (2010).
- Papineni, R. S. & Rosenthal, F. S. The size distribution of droplets in the exhaled breath of healthy human subjects. J. Aerosol Med. 10(2), 105–116 (1997).
- Sparrow, A. H., Underbrink, A. G. & Sparrow, R. C. Chromosomes and cellular radiosensitivity. I. The relationship of D0 to chromosome volume and complexity in seventy-nine different organisms. Radiat. Res. 32(4), 915–45 (1967).
- Lindenbach, B. D. Measuring HCV infectivity produced in cell culture and in vivo. Methods Mol. Biol. 510, 329–36 (2009).
- Mahy, B. & Kangro, H. Virology Methods manual. Academic Press (1996).
- Bjorck, A. Numerical Methods For Linear Least Squares Problems. Computer Science (1996).
- Walls, A. C. et al. Tectonic conformational changes of a coronavirus spike glycoprotein promote membrane fusion. Proc. Natl Acad. Sci. USA 114(42), 11157–11162 (2017).
- Madu, I. G. et al. Characterization of a highly conserved domain within the severe acute respiratory syndrome coronavirus spike protein S2 domain with characteristics of a viral fusion peptide. J. Virol. 83(15), 7411–21 (2009).
- Modrow, S. et al. Molecular virology. Springer Berlin Heidelberg (2013).
- Kangro, H. O. & Mahy, B. W. Virology methods manual. Elsevier (1996).
- Walker, C. M. & Ko, G. Effect of Ultraviolet Germicidal Irradiation on Viral Aerosols. Env. Sci. Technol. 41(15), 5460–5465 (2007).
- The International Commission on Non-Ionizing Radiation Protection, Guidelines on limits of exposure to ultraviolet radiation of wavelengths between 180 nm and 400 nm (incoherent optical radiation). Health Phys, 87(2), p. 171–186 (2004).
- ACGIH(R), 2017 TLVs and BEIs. Threshold Limit Value (TLV) for chemical substances and physical agents and Biological Exposure Indices (BEIs). Signature Publications (2017).
- Reed, L. J. & Muench, H. A simple method of estimating fifty per cent endpoints. Am. J. Epidemiol. 27(3), 493–497 (1938).
- Keene, O. N. The log transformation is special. Stat. Med. 14(8), 811–9 (1995).
- Venables, W. N. & Ripley, B. D. Modern applied statistics with S. 4th ed. Statistics and computing, New York: Springer, xi, 495 p (2002).
- Marazzi, A. Algorithm, Routines, and S functions for Robust Statistics. (Wadsworth & Brooks/cole, Pacific Grove, California, 1993).
- Durbin, J. & Watson, G. S. Testing for serial correlation in least squares regression. I. Biometrika 37(3-4), 409–28 (1950).
- Breusch, T. & Pagan, A. A simple test for heteroscedasticity and random coefficient variation. Econometrica 47(5), 1287–1294 (1979).
Remerciements
Ce travail a été entièrement soutenu par la Fondation Shostack et par la subvention R42-AI125006-03 du NIH. Nous remercions le Dr Alan W. Bigelow et Gary W. Johnson pour la conception initiale et la construction de la chambre à aérosols, ainsi que le Dr Gerhard Randers-Pehrson pour ses idées conceptuelles.
Informations sur l'auteur
Affiliations
Centre de recherche radiologique, Columbia University Irving Medical Center, New York, New York, 10032, USA
Manuela Buonanno, David Welch, Igor Shuryak & David J. Brenner
Contributions
M.B. a réalisé les expériences biologiques et analysé les données ; D.W. a réalisé l'installation de la chambre et la dosimétrie de la lampe ; I.S. a réalisé l'analyse statistique ; D.J.B. a supervisé les études et a fourni des conseils conceptuels. Tous les auteurs ont contribué à la préparation du manuscrit.
Correspondance avec l'auteur
Correspondance avec David J. Brenner.
Déclarations éthique
Intérêts concurrents
D.J.B. a obtenu un brevet intitulé "Apparatus, method and system for selectively affecting and/or killing a virus" (US10780189B2), qui concerne l'utilisation de lumière UV filtrée de 222 nm pour inactiver les virus. En outre, D.J.B. a une collaboration non financière en cours avec Eden Park Illumination, et l'institution des auteurs, l'université Columbia, a accordé une licence pour certains aspects de la technologie de la lumière UV à USHIO Inc.
Informations complémentaires
Accès libre - Cet article est placé sous licence Creative Commons Attribution 4.0 International License, qui autorise l'utilisation, le partage, l'adaptation, la distribution et la reproduction sur tout support ou dans tout format, à condition de créditer de manière appropriée le ou les auteurs originaux et la source, de fournir un lien vers la licence Creative Commons et d'indiquer si des modifications ont été apportées. Les images ou tout autre matériel tiers figurant dans cet article sont inclus dans la licence Creative Commons de l'article, sauf indication contraire dans une ligne de crédit vers le matériel. Si le matériel n'est pas inclus dans la licence Creative Commons de l'article et que l'usage que vous souhaitez en faire n'est pas autorisé par la réglementation ou dépasse l'usage autorisé, vous devrez obtenir l'autorisation directement auprès du détenteur du droit d'auteur. Pour consulter une copie de cette licence, visitez le site http://creativecommons.org/licenses/by/4.0/.