L'ozone c'est quoi ?
Quelques explications sur l'ozone et ses applications tous les jours.
L'ozone (de l'allemand Ozon, dérivé du grec ozô « exhaler une odeur »), ou trioxygène, est une substance de formule chimique O3 : ses molécules sont triatomiques, formées de trois atomes d'oxygène. L'ozone est ainsi une variété allotropique de l'oxygène, mais bien moins stable que le dioxygène O2, en lequel il tend naturellement à se décomposer. Il se liquéfie à 161,3K (−111,9 °C) sous forme d'un liquide bleu foncé et se solidifie à 80,7K (−192,5°C) en un solide pourpre. À température ambiante, c'est un gaz bleu pâle, voire incolore, qui se démarque par son odeur. L'ozone atteint son point critique à 5 460kPa et −12,05°C.
Comment "fabriquer" de l'ozone ?
L'ozone gazeux est composé de trois atomes d'oxygène. Il peut être produit lorsque l'énergie (ex. charge électrique > décharge corona) cassent une molécule stable (O2) en deux atomes d'oxygènes instables (O1). Ces atomes d'oxygènes seuls recherchent des molécules de O2 stables et se combinent pour former l'ozone (O3).
Son instabilité se manifeste à l'état condensé par une tendance à l'explosion lorsque sa concentration est significative. L'ozone se décompose en dioxygène O2 à température ambiante : la rapidité de la réaction dépend de la température, de l'humidité de l'air, de la présence de catalyseurs (hydrogène, fer, cuivre, chrome, etc.) ou du contact avec une surface solide.
C'est un gaz légèrement bleuté et contrairement au dioxygène inodore, il se perçoit par son odeur caractéristique pouvant rappeler l'eau de javel ou le chlore, décelable dès la concentration de 0,01PPM (PPM = particule par million, soit l'équivalent de 1 gramme par tonne) ou 1mg/L lorsqu'il est injecté dans l'eau; son odeur caractéristique qui rappelle l'eau de Javel est perceptible dans les endroits confinés où règne un champ électrique important (transformateur haute tension, échelle de Jacob, tubes UV, allume-gaz). Respiré en grande quantité, il est toxique et provoque la toux.
Le potentiel d’oxydation, autrement appelé potentiel redox, est la mesure de la tendance d’une espèce chimique à acquérir des électrons et à être réduit. Le potentiel d’oxydation est mesuré en tant que tension. Un potentiel d’oxydation plus élevé indique une plus grande tendance à la réduction, créant ainsi un échange d’électrons avec d’autres espèces chimiques. L’ozone a l’un des potentiels d’oxydation les plus élevés au monde, inférieur seulement à l’atome de fluor, à l’atome d’oxygène et au radical hydroxyle.
« L’ozone est plus efficace que le Chlore (Cl), le dioxyde de chlore (ClO2), l’acide hypochloreux (HOCl) et le peroxyde d’hydrogène (H2O2) »
L'ozone est naturellement présent dans l'atmosphère terrestre, formant dans la stratosphère une couche d'ozone entre 13 et 40km d'altitude qui intercepte plus de 97% des rayons ultraviolets du Soleil, mais est un polluant dans les basses couches de l'atmosphère (la troposphère) où il agresse le système respiratoire des animaux et peut brûler les végétaux les plus sensibles. Cet oxydant énergique agresse les cellules vivantes et peut être responsable de phénomènes de corrosion accélérés de polymères (« craquelage d'élastomères par l'ozone »).
Historique :
L'ozone a été découvert en 1789 par le chimiste hollandais Martin van Marum en faisant passer un courant électrique à travers de l'oxygène enfermé dans une éprouvette. Il relève une odeur spécifique comparable à celle de l'acide sulfureux ou du phosphore. L'éprouvette trempée dans le mercure lui permet d'observer que le volume d'oxygène diminue presque de moitié et que le mercure est très rapidement oxydé. Sans savoir ce que révélait son travail, il définit cette odeur comme étant celle de l'électricité et l'élément créé comme de l'acide azotique.
Cette étude est reprise en 1840 par le chimiste allemand Christian Friedrich Schönbein qui, en approfondissant les recherches de Van Marum, parvient à isoler la molécule. Il la dénomma ainsi en se référant à la racine grecque ozein (exhaler une odeur, sentir). La formule de l'ozone, O3, n'a été déterminée qu'en 1865 par Jacques-Louis Soret puis confirmée en 1867 par Christian Friedrich Schönbein. Par la suite, de nombreuses recherches sur le mécanisme de désinfection par l'ozone suivirent. Werner von Siemens fabriqua le tout premier générateur d'ozone à Berlin. Ce fabricant écrivit d’ailleurs un livre sur l'application de l'ozone dans l'eau, ce qui entraînera une multitude de projets de recherches sur la désinfection par l'ozone.
En 1907, le chimiste français Marius-Paul Otto, qui reçut un doctorat pour ses travaux sur l'ozone, créa une entreprise appelée Compagnie des Eaux et de l'Ozone.
La relation entre l’ozone et les oxydes d’azote a été mise en évidence dans les années 1970 par Paul Josef Crutzen, prix Nobel de chimie 1995.
Depuis juin 2023, l’Agence européenne des produits chimiques approuve l’ozone générée à partir d’oxygène en tant que substance active destinée à être utilisée dans les produits biocides des types 2, 4, 5 et 11 conformément au règlement (UE) no 528/2012 du Parlement européen et du Conseil.
https://eur-lex.europa.eu/legal-content/FR/TXT/HTML/?uri=CELEX:32023R1078
Les qualités de l'ozone :
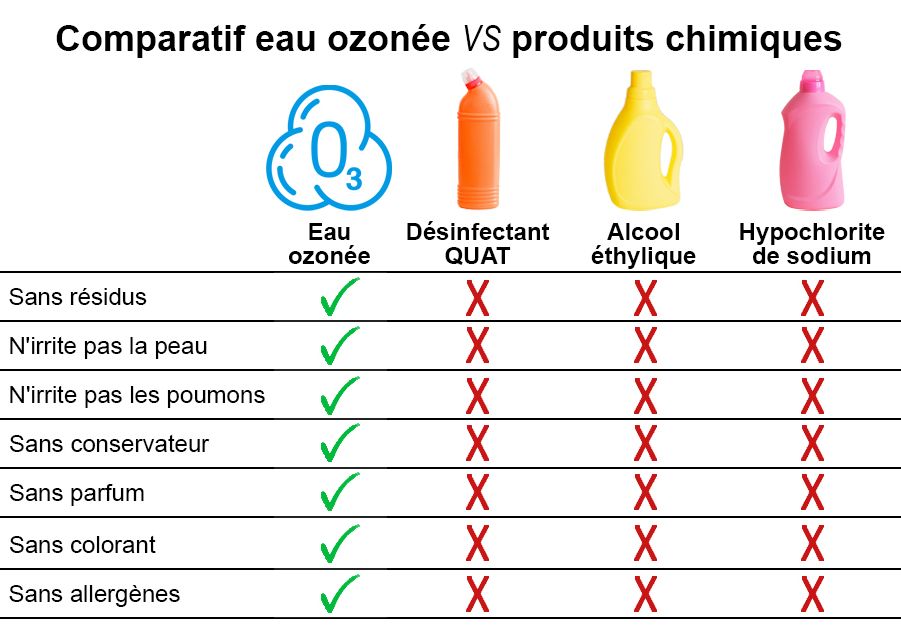
Sa pénétrabilité, sa grande réactivité et sa décomposition naturelle font de l’ozone le désinfectant idéal pour assurer la sécurité microbiologique des éléments et des équipements, sans laisser de résidus chimiques. Il s’avère plus efficace sur un ensemble beaucoup plus large de micro-organismes que tous les autres désinfectants.
EFFICACITE :
- Désinfection efficace
- 50 fois plus puissant que le Chlore sur les micro-organismes pathogènes
- Pouvoir oxydant 2070mV
- Tue les agents pathogènes, même à faible concentration
FIABILITE :
- Sans rémanence
- Ne laisse pas de traces
- Garantie une plus grande sécurité
ÉCOLOGIQUE :
- Sans résidu chimique
- Sans rinçage
- Sain pour l’environnement car il est naturel
ÉCONOMIQUE :
- Très peu de consommable
- Pas d’achat de produit
- Ne nécessite ni eau, ni rinçage
- Désinfection sans intervention humaine
- Économique à produire
Pourquoi l'ozone est associé à la pollution ?
Il ne faut pas confondre l’ozone stratosphérique, plus communément appelé « la couche d’ozone » qui protège la Terre des rayonnements ultraviolets du soleil, et l’ozone que l’on peut respirer à notre altitude.
Cet ozone des basses couches de l’atmosphère est un polluant dit « secondaire » car il n’est pas directement rejeté par une activité mais est ; une conséquence des rejets dès l’activité de transports et industrielles humaine. C’est une réaction chimique, sous l’effet des rayons du soleil, impliquant des polluants présents dans l’air, comme les oxydes d’azote, émis principalement par le trafic routier, et les composés organiques volatils (hydrocarbures, solvants…), rejetés par l’industrie.
L’ozone est donc généré comme une sorte d’auto-défense de la planète qui tente de neutraliser les polluants. Un niveau d’hydrocarbures élevé combiné à un fort rayonnement du soleil et une absence de vent peut conduire à des concentrations en ozone plus élevée. L’ozone a ainsi mauvaise réputation, même si ce sont les hydrocarbures qui posent problème.
Comment est fabriqué l'ozone ?
Dans la nature, l’ozone se forme naturellement dans l’atmosphère au contact des molécules d’oxygène de l’air par réaction photochimique, soit par rayonnement solaire (UV) soit par la foudre.
Nos procédés industriels utilisent quant à eux des générateurs de décharges électriques.
Une fois généré, l’ozone peut être utilisé sous forme aqueuse ou gazeuse, en fonction de l’application.
L’ozone est produit à partir d’un flux d’oxygène qui passe dans un espace de décharge électrique. Nous reproduisons via des générateurs l’action des éclairs lors d’important orage. Cette décharge-corona rompt la molécule stable d’oxygène O2 et forme deux atomes d’oxygène distinct O. Ces atomes (O) se combinent avec les molécules d’oxygène (O2) pour former l’ozone (O + O2 = O3).
Les électrons présents dans la décharge fournissent l’énergie nécessaire pour dissocier les atomes de la molécule d’oxygène : O 2 + e- => O + O
Ces atomes libres réagissent directement entre eux ou avec des molécules d’oxygène pour former de l’ozone : O 2 + O => O 3
Pour produire cette décharge, un milieu diélectrique est utilisé. La chaleur excessive des électrodes est souvent refroidie par l’eau de refroidissement, ou par de l’air en fonction des puissances nécessaires.
Pour produire de l’ozone il est possible d’utiliser de l’air ambiant, de l’air comprimé ou de l’oxygène pur. La qualité et la pureté du flux est primordial pour la bonne durée de vie du matériel. Pour conditionner cet air nous utilisons des sécheurs d’air et différents types des filtres à poussières, pour l’eau et l’huile.
Utilisations:
L'ozone est un gaz naturel créé à partir d'atomes d'oxygène. Il est un oxydant et un désinfectant puissant. Il est capable de détruire les virus, les bactéries, les fongiques et peut facilement être généré, même dans un espace clos.
L'ozone est un biocide enregistré à l'INRS, fiche toxicologique 43. Il n'est pas un produit chimique. En conséquence, à ce jour il ne rentre pas dans le protocole NORME 14476 (AFNOR : la norme EN 14476 est une norme européenne décrivant des actions de destructions des micro-organismes dans un milieu).
Il présente certains avantages par rapport à d’autres oxydants habituellement utilisés dans l’industrie, en particulier le chlore.
C'est l'un des désinfectants les plus puissants. Son potentiel d'oxydoréduction (ou potentiel redox) de 2,07 est très largement supérieur à celui du chlore qui est de 1,35. Cela revient à dire que l'ozone oxydera des éléments qui ne l'auraient pas été par le chlore, d'où des temps de contact bien plus courts pour un même résultat de désinfection.
L'ozone est un assemblage de 3 atomes d'oxygène, qui une fois produit n'aura qu'une priorité : oxyder tout ce qu'il rencontre (murs, machines, sols, personnel et même bactéries ambiantes et odeurs) en se dégradant en dioxygène. D'où aucun résidu dû à la dégradation de l'ozone et surtout demi-vie extrêmement courte en industrie (quelques minutes voire quelques secondes en pratique). Dans l'eau, l'ozone tend à redevenir de l'oxygène ne laissant ici non plus aucun résidu, il peut dès lors être utilisé pour le traitement d'eau ultrapure.
L'ozone est instable et cherchera toujours à revenir à son état originel (dioxygène / O2). La durée de la réaction dépend de la température ambiante, de l'humidité de l'air, de la présence de catalyseurs, de matières organiques, de la quantité et du type de contaminant bactériologique, fongique, viral ou autres.
Contrairement aux autres techniques de désinfection, l'utilisation d'ozone ne nécessite pas de stockage de produits dangereux puisqu'il est produit directement sur place et uniquement lorsque l'on en a besoin, conséquence directe de son instabilité.
Utilisations médicale ou Ozonothérapie:
L'ozone est utilisé comme antiseptique et bactéricide dans le traitement des plaies.
Autres utilisations:
Les propriétés oxydantes et désinfectantes de l'ozone sont encore mises à profit dans diverses situations.
En blanchisserie, pour le lavage de linge blanc dans les installations commerciales ou hospitalières. Cette application est très répandue dans les pays anglo-saxons, l'ozone est encore peu utilisé en Europe continentale, mais commence à ce développer dans les pressings.
Dans l'industrie agroalimentaire, pour la désinfection des chambres froides ou de produits alimentaires comme des légumes, des fruits, de la viande ou du poisson par bain d’eau ozonée. L'utilisation d'eau ozonée permet de ne modifier ni le goût, ni l'aspect des aliments, ni ces propriétés nutritionnelles. Il peut aussi être utilisé pour débarrasser les fruits et légumes des pesticides présents en surface.
Dans l'agriculture pour l'éradication des insectes (Sitophilus sp., Tribolium sp., etc.) au niveau du stockage des grains (blé, orge, etc.) par ozone gazeux. De plus, des recherches sont en cours pour la désinfection des grains au niveau des contaminants fongiques (Fusarium, Alternaria, etc.) ;
En micro-électronique, les wafers destinés à la fabrication de circuits intégrés sont lavés avec de l’eau ozonée avec pour objectif l’élimination de traces éventuelles de matières organiques.
En papeterie, l'ozone est employé comme agent de blanchiment alternatif au chlore.
L'eau ozonée est un moyen simple à mettre en œuvre pour la destruction de biofilms dans des conduites.
Informations complémentaires concernant l'ozone :