Désinfection rapide de surface en milieu hospitalier : analyse des essais comparés des méthodes chimiques et UV
Parution Hospitalia.fr, rédigé par Le Pr Sophie Alain, Mathis Courant, le Dr Philippe Carenco, Victor Vincentz le lundi 4 avril 2022
Étude, par le Pr Sophie Alain : médecin, virologue, responsable de la Structure C-Lim (UMR Inserm 1092 Université de Limoges) et du laboratoire de virologie P3 au CHU de Limoges (Service de Bactériologie-Virologie-Hygiène, CHU de Limoges) ; Mathis Courant : technicien en charge des essais (UMR Inserm 1092 Université de Limoges) ; le Dr Philippe Carenco : médecin hygiéniste, CH Hyères, CHU Nice, CPIAS PACA ; Victor Vincentz : CEO Concept Light.
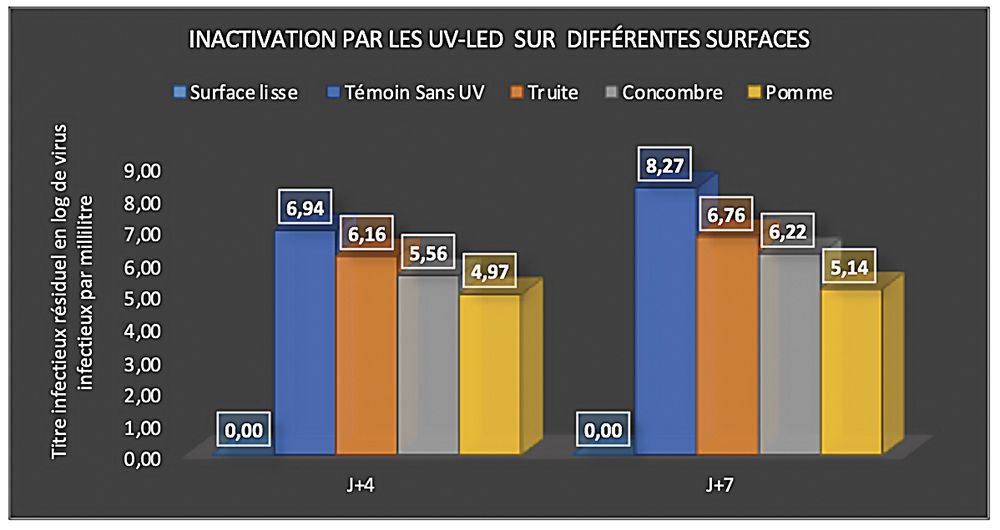
Schéma 1 : Réduction de la quantité de virus infectieux après exposition aux UV-LED STERILUV 10 secondes sur différentes surfaces alimentaires. Les logarithmes indiquent le titre en log de virus infectieux par millilitre, avec ou sans (Témoin) exposition aux UV-LED. Le titre infectieux est mesuré en culture de cellules Véro. Avec lecture après 4 et 7 jours d’incubation pour vérifier l’absence de foyers secondaires d’infection virale.
La pandémie de SARS-CoV-2 a monopolisé l'attention sur les procédures de sécurité telles que le port de masques, le lavage des mains et le nettoyage des surfaces. Parmi les modes de propagation possibles d'une infection, notamment à transmission par gouttelettes, figure la transmission par des surfaces contaminées (les "fomites" des Anglo-saxons). Un aspect important à considérer pour le choix du procédé de décontamination est la survie du virus sur différents types de surfaces lisses ou poreuses dans différents milieux. Cette survie diffère selon les surfaces et peut atteindre 72h dans des conditions favorables pour le SARS-CoV2. (Réf. 1 et 2).
En milieu hospitalier, le souci d’économie de santé, mais aussi la nécessité de limiter la sélection de bactéries résistantes, imposent une réflexion constante sur l’efficacité, l’utilité et la pertinence des moyens utilisés pour la décontamination des surfaces. Une décontamination rapide, dans le contexte du soin ou du travail en laboratoire, peut s’avérer nécessaire. Les désinfectants chimiques apportent une solution à cette question mais leur composition et leur efficacité peut varier d’un produit à l’autre. Un autre moyen désormais à disposition est l’utilisation d’une désinfection par exposition « flash » aux UV à l’aide de dispositifs portables.
Plusieurs fabricants proposent ce type de produit, sont rapportés ici les essais effectués avec la lampe STERILUV Compact qui utilise les UV-LED.
Dans ce sens, France UV-C propose différents modèles de lampes Far-UVC 222nm, encore plus puissantes que les lampes à UV 254nm, comme pour la valise portable avec sa lampe, idéale pour désinfecter tous les endroits où il n'est pas facile d'amener du courant et où la désinfection doit se faire efficacement, sans produits chimiques et plus rapidement qu'en faisant appel à une équipe d'entretien.
La structure C-Lim de l’Université de Limoges, spécialisée dans la validation de molécules ou de procédés chimiques ou physiques antiviraux a, dès le début de la crise Covid, dédié une part de son activité au SARS-CoV2, en collaboration avec le laboratoire de Bactériologie-Virologie-Hygiène du CHU de Limoges. Ce dernier est équipé d’un laboratoire Haute Sécurité P3, qui a mis en place la culture du SARS-CoV2, ainsi que l’isolement et la caractérisation des souches cliniques dès les premiers cas cliniques.
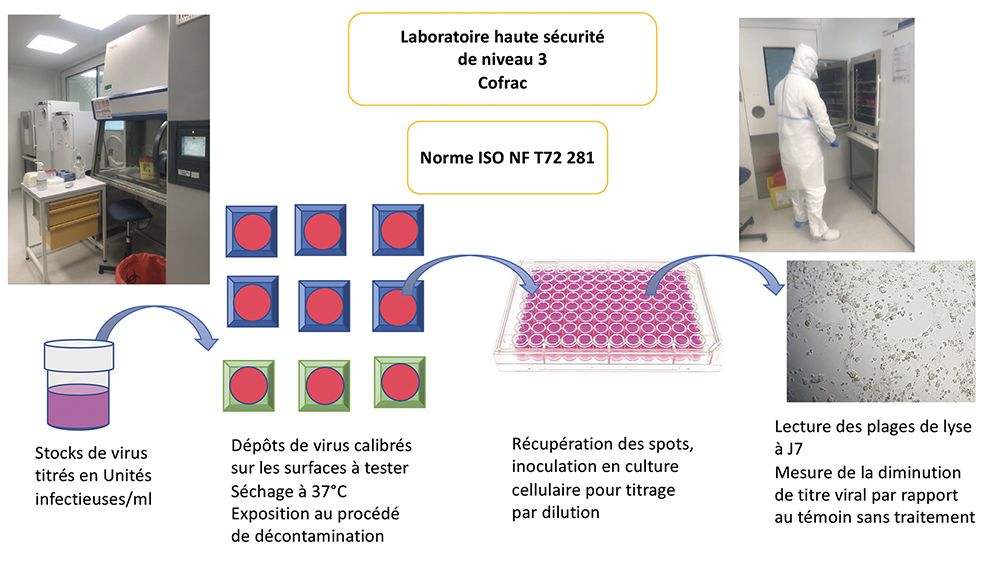
Bien que les conditions expérimentales ne reflètent pas totalement les conditions naturelles, la norme NF T72-281 décrit celles permettant de valider la qualité virucide de procédés de décontamination de surfaces. Nous avons donc comparé, suivant le protocole de la norme NF T72-281, différentes méthodes de désinfection en associant dans une même expérimentation deux désinfectants chimiques en aérosols liquides validés par l’AFNOR et marqués CE, un « savon hydroalcoolique » en spray validé NF 14476 pour le lavage des mains, et une méthode de désinfection physique utilisant des rayonnements UV-LED. Cette méthode associe une trilogie combinant 3 longueurs d’onde incluant des UV-C (265nm) endommageant les acides nucléiques ADN ou ARN bactériens ou viraux, et deux longueurs d’ondes complémentaires UV-LED jouant un rôle de catalyseur de l’inactivation des microorganismes et permettant de mieux visualiser la zone de rayonnement.
Protocole d’essai et résultats
Les essais ont été réalisés au laboratoire de Bactériologie-Virologie-Hygiène du CHU de Limoges, en conditions Haute Sécurité (laboratoire P3), par l’équipe de la structure C-Lim (CHU de Limoges et UMR Inserm 1092, de l’Université de Limoges).
Dans un premier temps nous avons validé l’efficacité de la trilogie UV-LED sur le virus SARS-COV2 en milieu liquide par étalement d’une goutte de 400 microlitres de suspension virale de souche SARS-CoV2 et de génotype 20A titrée à 5,36 10E6 unités (6,75 de virus infectieux/ml), pour pouvoir objectiver une diminution de 4 log du titre de virus infectieux, sur une surface de 4 cm². Après récupération de l’inoculum dans 10ml de milieu et titrage en TCID50 sur cellules Véro, 100% de l’inoculum viable est récupéré. Différentes conditions de distance et de durée d’exposition à la trilogie UV-LED utilisant l’appareil portatif STERILUV Compact ont été testées (3 essais par condition). L’exposition correspond à deux passages au-dessus de la surface d’une durée de 2, 4, ou 10 secondes à une distance définie :
Test 1 : 2 x 2 sec, 2 x 4 sec et 2 x 10 sec - distance 2cm sous UV.
Test 2 : 2 x 2 sec, 2 x 4 sec et 2 x 10 sec - distance 5cm sous UV.
Test 3 : 2 x 2 sec, 2 x 4 sec et 2 x 10 sec - distance 10cm sous UV.
Nous observons qu’il n’y a pas de virus résiduel (100% d’inactivation) avec :
- Tous les temps d’exposition à une distance de 2cm
- Au moins 2 x 4 sec et 2 x 10 sec à 5cm
- Au moins 2 x 4 sec et 2 x 10 sec à 10cm
Au-delà de 2cm de distance, l’exposition 2 x 2 secondes n’est plus efficace (31% et 40% d’inactivation virale).
Ceci démontre d’une part la puissance et la rapidité de l’inactivation par la trilogie UV-LED sur le SARS-CoV2, mais souligne également l’importance de la bonne utilisation de ce type d’inactivation physique en termes de temps d’exposition mais aussi de distance à la cible.
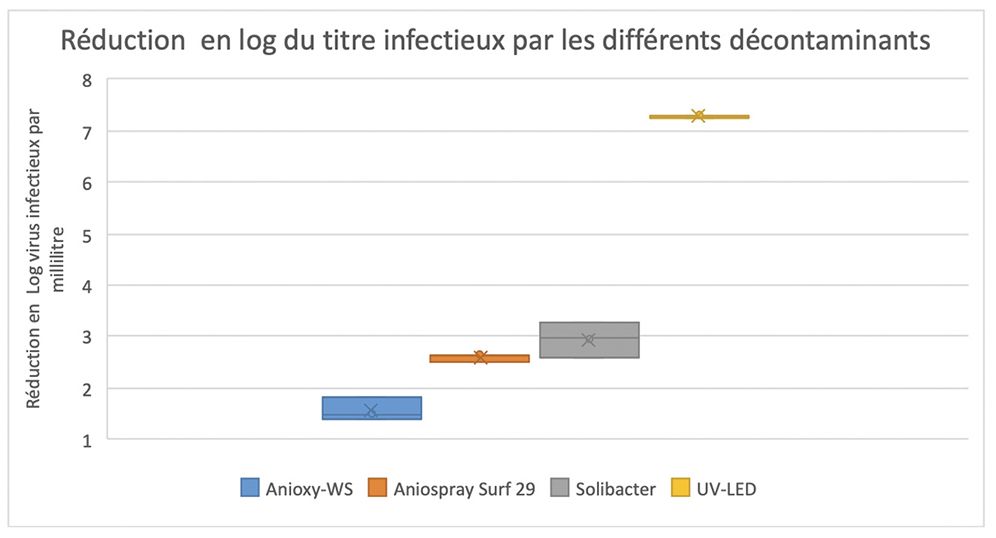
Schéma 2 : réduction de la quantité de virus infectieux, mesurée par culture du virus après exposition au procédé de décontamination, UV-LED ou aérosols chimiques. Le virus est titré en culture et le titre est exprimé en log de virus infectieux par millilitre. La réduction est mesurée par la différence de titre entre le dépôt Témoin, non exposé à la décontamination et le dépôt ayant subi la décontamination. UV = Trilogie UV-LED. Les résultats sont lus après 7 jours d’incubation pour vérifier l’absence de foyers secondaires d’infection virale.
Dans un deuxième temps, nous avons regardé l’efficacité des UV-LED sur des surfaces poreuses alimentaires.
Nous avons utilisé comme surface des épluchures de concombre et de pomme, et un filet truite crue avec peau, trois aliments de porosité différente et potentiellement souillés par les mains. Le protocole utilisé est identique à celui décrit ci-dessus : l’inoculum a été déposé sur la face externe des échantillons (côté peau) et traité comme les autres échantillons. Un seul temps d’exposition aux UV-LED a été testé, de 10 secondes, afin d’être dans les conditions d’efficacité maximale. Les essais ont été réalisés en triplicat.
Nous observons une diminution du titre en virus infectieux, cependant très inférieure à celle observée sur surface lisse (schéma 1), avec un pourcentage d’inhibition de 18%, 25% et 38% sur la peau de truite, de concombre et de pomme, respectivement. Compte tenu de l’efficacité observée plus haut, ceci attire l’attention sur le choix du type de surface traité au UV-LED pour garantir le maximum d’efficacité.
Dans un troisième temps, nous avons réalisé la comparaison UV-agents chimiques sur inoculum sec (afin de mimer les « fomites »).
Nous sommes partis du même virus et du même inoculum, soumis à un séchage complet à 37°C. Pour cet essai nous avons choisi d’utiliser les recommandations des fabricants de solutions virucides, soit une exposition de 5 minutes (durée la plus longue recommandée). Nous avons également calibré le volume émis par les aérosols des différents produits chimiques de façon à utiliser des volumes de produit comparables.
Brièvement, le protocole associe dépôt sur un support lisse (boîte de Petri) d’un volume calibré de virus titré. Puis séchage et récupération du virus viable par rinçage de la surface contaminée sèche avec 10ml de milieu de culture sans sérum. Et mesure du titre en virus infectieux récupéré après dilution et culture en cellules Véro. Par cette méthode, 98% du virus déposé est récupéré sous forme viable, en l’absence de tout traitement décontaminant. Le virus persiste donc à l’état viable dans les pseudo « fomites » sur la surface lisse.
La surface contaminée a ensuite été exposée pendant 5 minutes à 3 solutions décontaminantes en spray : Anioxy-WSâ (Anios), habituellement utilisées dans notre laboratoire P3 et Anioxyspray Surf29â (Anios), et SoliBacterâ (Solibio) un « savon hydroalcoolique » en spray (solution virucide prête à l’emploi pour désinfection des mains, validée selon la norme NF14476), utilisés dans notre unité de recherche. En parallèle, nous avons exposé pendant 5 minutes l’inoculum à la trilogie LED-UV STERILUV à 2cm de distance.
Les résultats de trois essais consécutifs sont concordants, et sont présentés dans le graphe du schéma 2.
La réduction minimale du titre viral exigée par la norme pour conclure à une activité virucide est de 4 logs pour les méthodes UV et 2 logs pour les méthodes chimiques. La réduction du titre viral obtenue par rapport au témoin non exposé a été de 100%, soit 7,8 log, avec la trilogie UV-LED, de 22% soit 1,56+/- 0,22 logs pour Anioxy-WSâ, de 36% soit 2,61=/-0,08 logs pour Anioxyspray-Surf29â et de 2,78+/-0,34 pour SoliBacterâ. À titre indicatif, nous avions également testé les UV du poste de sécurité microbiologique en parallèle pendant 5 minutes, et obtenu une inactivation à 100%.
Protocole d’essai au Laboratoire P3 du CHU de Limoges. © Sophie Alain, laboratoire de Bactériologie-Virologie-Hygiène, CHU de Limoges
Conclusions
L’avis du virologiste :
Ces essais montrent clairement la puissance d’inactivation des UV ou UV-LED. Les solutions décontaminantes ont été utilisées selon la norme NF T72-281 en respectant le temps d’exposition, et nos résultats montrent que certaines solutions, pourtant recommandées en laboratoires P3 pour leur excellente efficacité sur les mycobactéries et le HIV sont, dans nos conditions expérimentales, en dessous des valeurs attendues pour la norme en ce qui concerne le SARS-CoV2. Inversement, le « savon hydroalcoolique » satisfait à la norme pour la décontamination de surface, avec un temps de contact de 5 minutes.
La Trilogie UV-LED au format STERILUV a montré une efficacité de 100% avec un délai d’exposition très court, permettant de neutraliser presque instantanément le virus infectieux présent dans les pseudo « fomites » ou des projections humides sur une petite surface, sans exposition à des aérosols chimiques. Ce procédé est beaucoup moins efficace sur les surfaces potentiellement poreuses. Dans ces conditions, même si une diminution du titre viral est observée, cette diminution reste très inférieure aux attendus de la norme. Cette solution est simple d’utilisation, ne sélectionne pas de pathogènes résistants, et pourrait être un complément utile de décontamination dans nos laboratoires, notamment sur de petites et moyennes surfaces non poreuses.
L’avis de l’hygiéniste hospitalier :
La désinfection de surface par UV utilisant le dispositif STERILUV présente des qualifications normatives, des résultats expérimentaux et des performances sur le terrain (Réf. 5) qui allient efficacité et préservation de l’environnement.
Points positifs
- Mise en œuvre ergonomique.
- Application manuelle permettant d’assurer l’action sur les surfaces propres.
- Sécurité d’emploi sous réserve du respect des préconisations concernant la protection contre l’exposition cutanée, le port de gants et de lunettes.
- Contrairement aux désinfectants chimiques : Absences d’émission de gaz ou vapeur irritante, d’effet indésirable par contact, de dépôt de substance pouvant interférer avec l’activité pratiquée, de rejet dans les eaux usées et d’utilisation de textiles de nettoyage. Respect de l’intégrité des matériaux.
Usages pertinents sur des surfaces lisses et propres, par secteurs de l’activité hospitalière :
- Laboratoire : désinfection des plans de travail, des surfaces des postes de sécurité microbiologiques et des surfaces des enceintes en froid positif.
- Stérilisation : désinfection des plans de travail en zone de conditionnement.
- Pharmacie : désinfection des surfaces du préparatoire, des surfaces des hottes de reconstitution et des surfaces des enceintes en froid positif.
- Dépôts de sang : désinfection des surfaces de préparation des lots à délivrer et des enceintes réfrigérées.
- Services d’urgences : désinfection des surfaces de préparation de soins techniques, des cellules des véhicules de secours, des écrans tactiles des appareils de surveillance, des surfaces des postes de saisie informatique partagés, des surfaces des points d’accueil et des écrans de protection du personnel d’accueil.
- Bloc opératoire : désinfection des surfaces en contact avec l’opéré.
Références bibliographie :
- Neeltje van Doremalen, Trenton Bushmaker, Dylan H. Morris et al. Aerosol and surface stability of HCoV-19 (SARS-CoV-6 2) compared to SARS-CoV-1. The New England Journal of Medicine doi : 10.1056/NEJMc2004973
- Max Bueckert, Rishi Gupta, Aditi Gupta, et al. Infectivity of SARS-CoV-2 and Other Coronaviruses on Dry Surfaces: Potential for Indirect Transmission. Materials 2020, 13, 5211; doi:10.3390/ma13225211
- NF T72-281. Procédés de désinfection des surfaces par voie aérienne, bactéricide, fongicide, levuricide, mycobactéricide, tuberculocide sporicide et virucide incluant les bactériophages. AFNOR, 8 novembre 2014.
- AFNOR SPEC T72-902. Août 2021. AFNOR Spec en vigueur. Utilisation de la technologie du rayonnement UV à des fins de désinfection ou de décontamination.
- Désinfection des surfaces par exposition aux ultraviolets C, validation des performances d’un appareil à LED au centre hospitalier de Haguenau. O. Meunier, HYGIÈNES - 2021, 29,4, pp 301-5
TRILOGIE UV-LED montrant l’éclairage obtenu avec la lampe STERILUV. Les UV-C ne sont pas visibles. La zone repérée avec les longueurs d’onde UV -LED complémentaires est mieux perceptible et augmente la sécurité d’utilisation. © Mathis Courant, UMR Inserm 1092, Université de Limoges.